2025年8月29日,由上海交通大学医学院上海市免疫学研究所Svetoslav Chakarov团队,在国际期刊Science(IF=56.9)在线发表题为:Septal LYVE1+ macrophages control adipocyte stem cell adipogenic potential 的论文。该团队研究发现了一类稀有的巨噬细胞亚群——CD209b+LYVE1+隔膜巨噬细胞(sATMs),它们特异性定位于白色脂肪组织(WAT)的小叶隔膜内(Septal)——这是一个富含胶原蛋白与透明质酸的微环境,同时也是具有多向分化潜能的CD26+脂肪干细胞(adipocyte stem cells:ASCs)的聚集区域。这类巨噬细胞主要源于胚胎发育阶段,并能长期维持其生态位特性。白色脂肪组织(WAT)的隔膜(septum)里,LYVE1⁺/CD209b⁺/TIM4⁺的驻留型巨噬细胞(sATMs)通过TGFβ1近程信号指挥CD26⁺脂肪干细胞(ASCs)分化走向白脂;清除该亚群或沉默其 TGFβ1,可促进米色化、提高能量消耗、抵抗肥胖。此外,类似的细胞群体在人体脂肪组织中也被鉴定出来。

脂肪组织(AT)是一个动态的器官,由储存脂质的脂肪细胞、脂肪细胞干细胞(ASCs)和驻留免疫细胞组成。巨噬细胞是AT中丰富的免疫细胞之一,根据生理环境的不同,可以维持组织功能或引发炎症。之前的研究已经描述了肥胖中的炎症巨噬细胞,但在稳态下,驻留巨噬细胞的身份和作用,以及它们与基质细胞群体的相互作用尚不清楚。最近的证据表明,巨噬细胞的专业化可能不仅限于组织级的生态位,还延伸到更精细的“亚组织"区室。这种定位是否会影响AT巨噬细胞的身份和功能仍未解决。
在白色脂肪组织(WAT)中,该研究团队确定了三种巨噬细胞群体,它们具有不同的定位、周转和表型。通过整合转录组、蛋白质组和空间图谱分析,作者根据解剖位置鉴定了三种不同的脂肪组织巨噬细胞(ATM)亚群:实质巨噬细胞(pATMs)、被膜巨噬细胞(cATMs)和间隔巨噬细胞(sATMs)。其中,sATMs以表达CD209b和LYVE1为特征,特异性地定位于分隔脂肪小叶的胶原和透明质酸丰富的间隔结构中。被膜区(cATMs)集中在组织最外层的包膜中,高表达LYVE1但是不表达CD209b;实质区(pATMs)分散在脂肪细胞之间,低表达LYVE1和CD209b,可能对应于MHCII-hi ATM。与单核来源的pATMs相比,sATMs具有胚胎起源、长期存留和低更新率的特点。
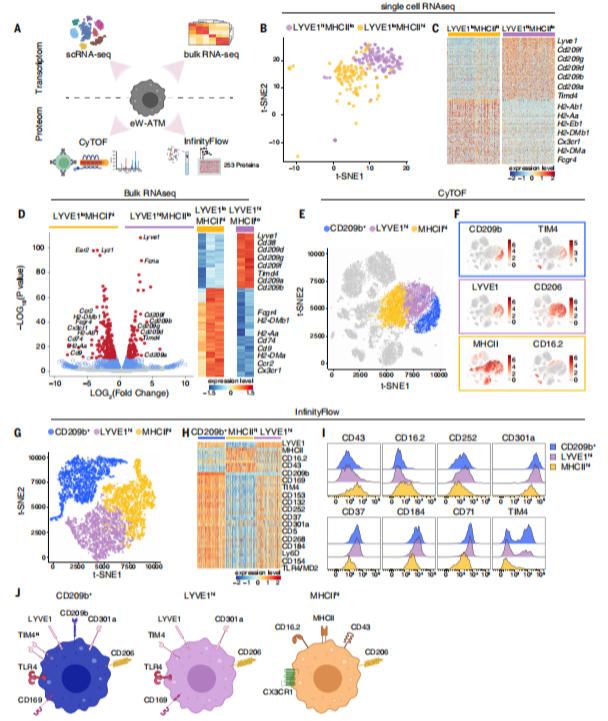
脂肪组织巨噬细胞亚群分型和解剖结构定位
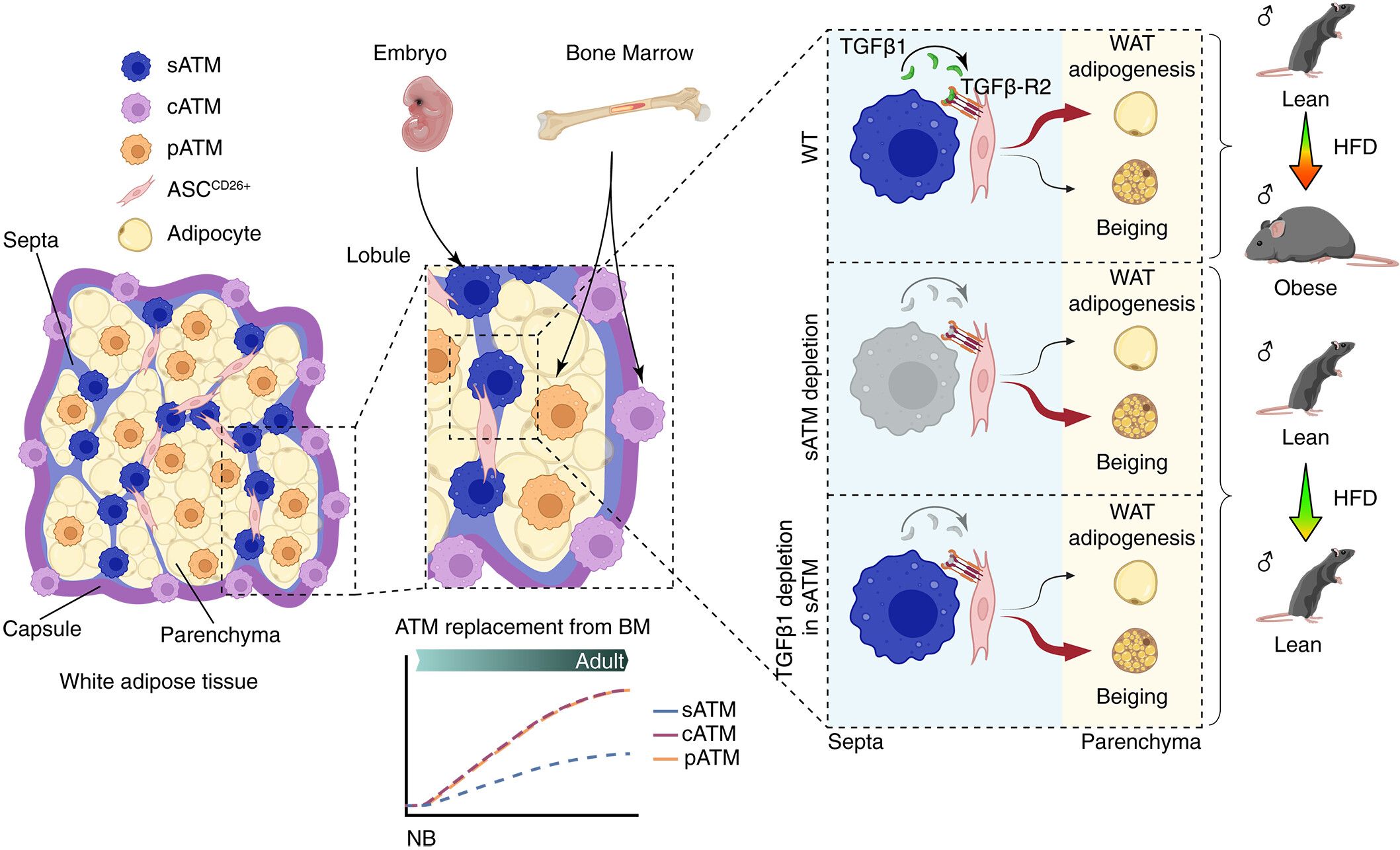
研究团队还分析了在高脂饮食(HFD)诱导的肥胖过程中这些ATM的动态变化。结果发现了pATMs逐渐增加,而sATMs和cATMs在绝对数量和相对比例上均下降。高脂饮食6个月后,pATMs成为eWAT中的主要巨噬细胞群体。相比sATMs,cATMs和pATMs的更新变化主要来自于循环单核细胞。通过构建 Cd209b-DTR 小鼠模型,选择性清除特异去除 sATMs,直接证明sATMs 的核心生理功能,是研究因果关系的关键证据。利用 Cd209b-DTR 小鼠模型删除 sATMs 后,发现小鼠出现:① 产热增强、白色脂肪组织褐变;② 高脂饮食下抵抗肥胖,改善葡萄糖耐受和胰岛素敏感性;③ 减少肝脂肪变性;④脂肪干细胞向白色脂肪分化受阻。这是在体内证实sATMs 是抑制产热、促进白色脂肪生成的关键调控因子,为靶向sATMs提供了直接的功能证据,是连接细胞定位与生理功能的桥梁。
在 Lyve1^CreERT2;Tgfb1^flox 与 Timd4^Cre;Tgfb1^flox 两模型中,特异敲除巨噬细胞 Tgfb1。验证TGFβ1 通路的分子机制。TGFβ1 缺失后,小鼠表型与sATM depletion 一致(抗肥胖、改善代谢、产热增强);ASCs¹⁰²⁶⁺向白色脂肪分化能力下降,向米色脂肪分化能力强;体外实验证实TGFβ1直接抑制ASCs的褐变潜能,下调adipogenesis 相关基因(如 Pparg、Fabp4)。该研究明确了sATM 分泌的TGFβ1是调控ASCs命运的关键信号分子,补充细胞互作到分子机制 的缺口,为 “靶向sATM-TGFβ1-ASC 轴" 的治疗策略提供了直接靶点证据。
介绍:
脂肪组织(AT)是一个动态的器官,由储存脂质的脂肪细胞、脂肪细胞干细胞(ASCs)和驻留免疫细胞组成。巨噬细胞是AT中丰富的免疫细胞之一,根据生理环境的不同,可以维持组织功能或引发炎症。之前的研究已经描述了肥胖中的炎症巨噬细胞,但在稳态下,驻留巨噬细胞的身份和作用,以及它们与基质细胞群体的相互作用尚不清楚。最近的证据表明,巨噬细胞的专业化可能不仅限于组织级的生态位,还延伸到更精细的“亚组织"区室。这种定位是否会影响AT巨噬细胞的身份和功能仍未解决。
原理:
我们假设AT内的亚组织巨噬细胞小环境作为ASC命运规定的指导中心。通过在小鼠和人类中进行空间、转录组和功能分析,我们调查了特定的巨噬细胞亚群是否定位于特定的AT区室,与祖细胞相互作用,并调节脂肪生成。
结果:
我们根据亚组织位置和分子特征定义了三种不同的脂肪组织巨噬细胞(ATM)群体:实质性(pATMs)、囊性(cATMs)和隔膜性(sATMs)。sATMs以CD209b和LYVE1(CD209b LYVE1)表达为特征,主要集中在小叶内隔膜,这是一种在脂肪细胞小叶中穿行的富含胶原蛋白和透明质酸的致密结构,靠近早期CD26表达的幼稚脂肪前体细胞(ASCsCD26)。这些sATMs主要来源于胚胎,寿命长,并且与单核细胞来源的、与炎症相关的ATMs不同。面对高脂饮食(HFD)挑战,sATMs保持了空间限制并抵抗了单核细胞替代,而pATMs数量通过局部增殖和单核细胞涌入而增加。采用Cd209b驱动的DTR模型选择性去除sATMs增强了产热作用、白色脂肪组织的棕色化、增加了氧气消耗,并在不依赖于食物摄入的情况下保护免受HFD诱导的肥胖。这些小鼠还表现出改善的葡萄糖耐受性和胰岛素敏感性,以及减少的肝脂肪变性。
对AT基质部分进行单细胞和群体RNA测序鉴定出ASCsCD26是高增殖的早期前体,位于隔膜中。在sATM去除后,ASCCD26的频率下降,其转录特征转向产热、棕色/棕褐色命运。配体-受体相互作用建模确定TGFβ1是sATMs来源的信号,通过TGFβR1/2作用于ASCs。在体内特定去除LYVE1或TIM4巨噬细胞中的Tgfb1复现了sATM去除的表型。在体外,从TGFβ1缺乏小鼠中提取的ASCsCD26显示白色脂肪生成分化受损,热能转换能力更强。
我们在肥胖患者中识别出一群保守的CD206 LYVE1人类隔膜ATMs(hsATMs),它们表达高水平的TGFB1,并位于CD26 CD55早期人类ASCs(hASCsCD26)附近。多重成像确认hsATMs与hASCsCD26在人体白色脂肪组织的隔膜区内密切接近。
结论:
亚组组织定位可能是巨噬细胞功能的一个关键决定因素,并将脂肪隔膜定位为一个离散的免疫代谢小环境, 对组织重塑至关重要。我们的研究结果定义了一个空间上有限的小环境,其中包含驻留的巨噬细胞和干细胞,位于白色脂肪组织的隔膜内,调控脂肪组织的可塑性和能量平衡。隔膜中的巨噬细胞提供了局部的TGFβ1信号,这些信号引导早期脂肪细胞前体向白色脂肪细胞分化,同时限制其产热潜力。该sATM小环境的耗竭或功能失活使ASC命运转向米色脂肪发生,增强能量消耗,并在肥胖中提供系统性的代谢益处。这个隔膜驻留巨噬细胞与脂肪细胞前体之间的调节轴增进了对代谢组织中免疫-基质交互作用的理解。靶向sATM–TGFβ1–ASC轴可能提供治疗策略,以增强白色脂肪组织的米色化,并抵消肥胖和胰岛素抵抗,而不会引发炎症。
荷兰Liposoma的巨噬细胞清除剂Clodronate Liposomes,氯膦酸盐脂质体,广泛用于体内单核巨噬细胞清除,频频登刊Cell,Nature和Science。如果您也在研究巨噬细胞,需要订购巨噬细胞清除剂剂,就可以随时联系大中华办事处靶点科技(Target Technology),专业技术团队给您巨噬细胞清除提供整套解决方案。
原始文献:
Xiaotong Yu et al., Septal LYVE1+ macrophages control adipocyte stem cell adipogenic potential. Science389,eadg1128(2025). DOI:10.1126/science.adg1128